WP1. MECANISMOS MOLECULARES EN LA DISFUNCIÓN DE LOS ÓRGANOS RELEVANTES EN EL CONTROL DE LA SENSIBILIDAD A LA INSULINA.
LI 1: Identificación de mediadores y mecanismos moleculares en el interactoma intra y extrahepático en la resistencia a la insulina (RI) asociada a obesidad.
- Coordinador: HEPIR
- Participantes: GESTOBES, METABOALL y DIABEHEART-DIABEMAC
Objetivos:
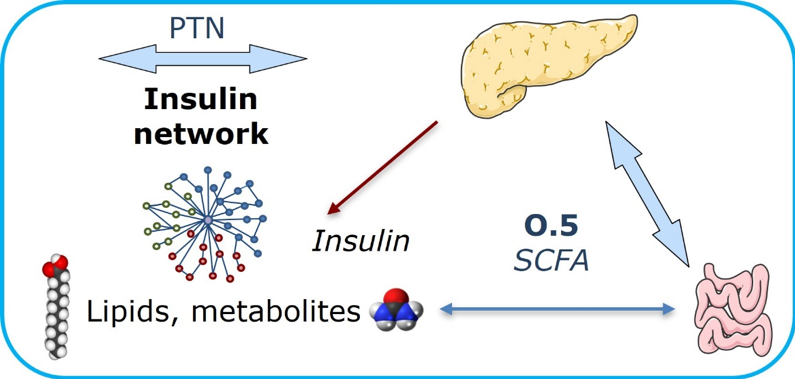
- Estudiar el efecto de los ácidos grasos de cadena corta (SCFAs) derivados del metabolismo bacteriano intestinal sobre la producción y composición de las VEs por las células epiteliales del colon en condiciones fisiológicas y proinflamatorias (estudios in vitro).
- Estudiar el efecto de las VEs de origen intestinal sobre la función y supervivencia de las células β pancreáticas (estudios in vitro).
- Efectos in vivo de las VEs de origen intestinal sobre la función y supervivencia de las células β pancreáticas: aproximaciones en dos modelos murinos de RI inducida por la dieta o por la deleción del receptor de insulina en el hígado.
LI 2: Identificación de nuevas moléculas en la disfunción cardiaca en situaciones de resistencia a insulina y mecanismos moleculares asociados.
- Coordinador: DIABEHEART-DIABEMAC
- Participantes: GESTOBES, METABOALL y HEPIR
Objetivos:
- Estudiar el impacto funcional de RXR en el corazón adulto: evaluación fenotípica del modelo de ratón deficiente en RXR cardio específico.
- Caracterizar el mecanismo molecular mediante el cual RXR controla la homeostasis metabólica del corazón adulto.
- Investigar el impacto de RXR en la disfunción mitocondrial como mecanismo subyacente a la cardiomiopatía diabética
LI 3: Identificación de nuevas moléculas en la disfunción renal en situaciones de RI: mecanismos moleculares asociados.
- Coordinador: LIPOBETA
- Participantes: GESTOBES, METABOALL y HEPIR
Objetivos:
- Investigar el papel de TGFβ3 en el desarrollo de fibrosis asociada al desequilibrio entre la lipogénesis de novo y la oxidación de ácidos grasos que conducen a la apoptosis celular.
- Investigar el papel de TGFβ3 en el desarrollo de fibrosis asociada a procesos de inflamación.
- Investigar el papel de TGFβ3 en el desarrollo de fibrosis asociada al estrés del RE y estrés oxidativo.
LI 4: Complicaciones cardiovasculares asociadas a la resistencia a la insulina: papel de los receptores nucleares en la miocardiopatía diabética.
- Coordinador: GESTOBES
- Participantes: LIPOBETA, METABOALL y HEPIR
Objetivos:
- Estudiar la implicación de la PTN en la inflamación del tejido adiposo asociada a la RI en obesidad.
- Caracterización molecular de la vía de señalización mediada por PTN y su posible contra regulación por la midkina en la inflamación del tejido adiposo asociada a la RI en este órgano endocrino.
WP2: IDENTIFICACION DE MECANISMOS EN LA DISFUNCIÓN DE EJES RELEVANTES QUE AFECTAN A LA SENSIBILDAD A LA INSULINA.
LI 1: Estudio de los mecanismos de comunicación del eje entero-insular en estados de resistencia a la insulina.
- Coordinador: ENTEROBETA
- Participantes: LIPOBETA, METABOALL y DIABEHEART
Objetivos:
- Estudiar la implicación de la PTN en la inflamación del tejido adiposo asociada a la RI en obesidad.
- Caracterización molecular de la vía de señalización mediada por PTN y su posible contra regulación por la midkina en la inflamación del tejido adiposo asociada a la RI en este órgano endocrino.
LI 2: Eje neuro-insular-adiposo: implicación de la pleiotrofina en la conexión de la metainflamación periférica asociada a la obesidad con la neuroinflamación.
- Coordinador: GESTOBES
- Participantes: ENTEROBETA, METABOALL y HEPIR
Objetivos:
- Estudiar el papel de la PTN en la señalización de insulina y el metabolismo del sistema nervioso central en ratones obesos.
- Analizar el secretoma circulante en un modelo de obesidad inducida por dieta en ratones.
- Estudiar los efectos de la PTN en el secretoma de los adipocitos, células beta pancreáticas y neuronas.
LI 3. Estudio de los mecanismos de comunicación del eje adiposo-renal: efecto del secretoma del tejido adiposo en la enfermedad crónica renal asociada a la obesidad y RI.
- Coordinador: LIPOBETA
- Participantes: ENTEROBETA, METABOALL y DIABEHEART-DIABEMAC
Objetivos:
- Evaluar la estructura y función secretora del tejido adiposo en ratones hembras y machos TGFβ3+/en condiciones de dieta normal y rica en grasa.
- Estudiar el perfil génico/proteico de los receptores de adipoquinas y estrógenos en el riñón de los ratones TGFβ3+/.
- Estudiar la interacción de las adipoquinas, miRNAs contenidos en VEs y las hormonas sexuales esteroideas en la vía de señalización del TGFβ3 y su papel en la fibrosis renal asociada a obesidad.
WP3. APROXIMACIÓN TRASLACIONAL EN SITUACIONES METABÓLICAS QUE CURSAN CON RESISTENCIA A LA INSULINA
LI 1: Identificación de nuevos biomarcadores en la enfermedad renal crónica asociada a obesidad.
- Coordinador: LIPOBETA
- Participantes: ENTEROBETA, METABOALL y HEPIR
Objetivos:
- Identificar miRNAs de las VEs, metabolitos, lípidos y proteínas en muestras de suero y orina como biomarcadores del desarrollo de nefropatía durante el progreso de la RI asociada a obesidad.
- Caracterización de los nuevos biomarcadores identificados y estudiar su implicación en el desarrollo de nefropatía asociada a la obesidad y el efecto de posibles tratamientos (cirugía bariátrica y un fármaco anti-obesidad).
- Validación en una línea de podocitos humanos del papel funcional de las redes de lipidómica, metabólica y proteómica, así como los miRNAs identificados en pacientes obesos con enfermedad renal crónica.
LI 2: Impacto de las VEs plasmáticas de individuos con EHGNA en el eje hígado-páncreas.
- Coordinador: HEPIR
- Participantes: ENTEROBETA y METABOALL
Objetivos:
- Aislar y caracterizar las VEs circulantes de una cohorte de individuos con diferentes etapas de EHGNA (desde hígado graso hasta fibrosis).
- Investigar si el cargo lipotóxico/inflamatorio de las VEs circulantes de individuos con EHGNA tiene per se un impacto deletéreo en un hígado sano.
- Dilucidar el efecto de las VEs de individuos con EHGNA en el páncreas.
LI 3: Búsqueda de biomarcadores tempranos de diabetes gestacional.
- Coordinador: GESTOBES
- Participantes: DIABETEHEART-DIABEMAC y METABOALL
Objetivos:
- Validación de los polimorfismos rs10830963 y rs1387153 del gen MTNR1B en una cohorte de mujeres embarazadas para completar el estudio semiológico de estos potenciales biomarcadores de diabetes gestacional temprana.
- Identificación de otros biomarcadores de diabetes gestacional (miRNAs de las VEs, y metabolitos, en muestras de suero).